阿尔兹海默症的无症状早期迹象:胶质细胞增多伴随严重的神经炎症反应
阿尔兹海默症(AD)是老年期痴呆症最常见的一种类型,也是老年人中最常见的一种神经退行性疾病。过去针对淀粉样蛋白(Aβ)的临床药物开发多以失败告终,到现在为止也没有有效的基于神经元为中心的治疗方法,因此,目前研究重点开始从神经元转向胶质细胞,从寻找AD晚期的治疗策略转到针对AD无症状早期的预防。
近年来越来越多的研究表明,神经炎症参与并加剧了AD的发病进展。神经炎症被认为主要由小胶质细胞和星形胶质细胞驱动,并随着AD的神经退行性进展而升级。然而,在神经退行的不同阶段,尤其是发病早期,胶质细胞和神经炎症反应如何参与疾病发生以及影响哪些特定脑区和关键时间点仍不清楚。
2022年9月,华东师范大学心理与认知科学学院李春霞副研究员和王惠敏研究员的研究团队在国际知名期刊Frontiers in Aging Neuroscience在线发表了题为“Spatiotemporal patterns of gliosis and neuroinflammation in presenilin 1/2 conditional double knockout mice”的研究论文。该论文探究了由早发性AD的风险基因早老素缺乏引起的神经退行性病变中胶质细胞和免疫炎症因子的动态变化模式,有助于理解神经退行性病变的早期发病机制,并为在老年痴呆症的无症状早期阶段通过改变胶质细胞激活和神经炎症水平来阻止神经退行的发生和发展提供了新的治疗思路。

研究发现,早发性AD模型动物在无认知损伤和大脑细胞死亡的无症状早期阶段,不同脑区就表现出明显的异常,特别是在AD的早期临床病人上发现存在萎缩和体积变小的躯体感觉皮层和压后皮层区域。研究发现,在躯体感觉皮层脑区,六周龄和两月龄的早发性AD模型动物的星形胶质细胞数量显著增加(图1),在压后皮层脑区,星形胶质细胞和小胶质细胞的数量均显著增加(图2),而在海马脑区,两种胶质细胞数量均未改变(图略)。以上结果显示,在老年痴呆症的无症状早期阶段,不同脑区受影响程度不同,和海马脑区相比,皮层脑区更早被影响,也更严重,并且星形胶质细胞增生的发生也早于小胶质细胞增生,可能是疾病发生的早期触发因素。
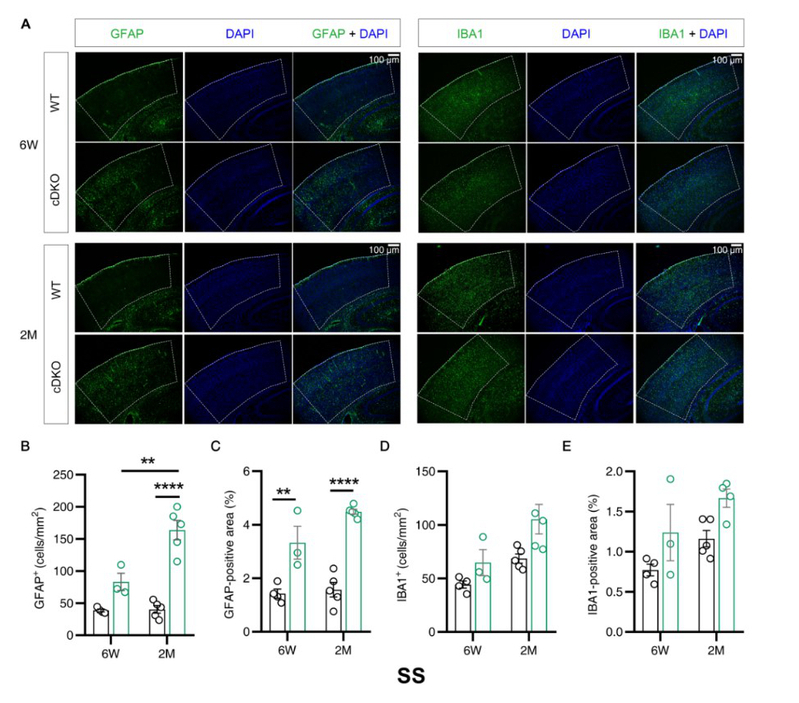
图1.六周龄早发性AD模型动物躯体感觉皮层(SS)中星形胶质细胞数量显著增加,小胶质细胞数量未改变
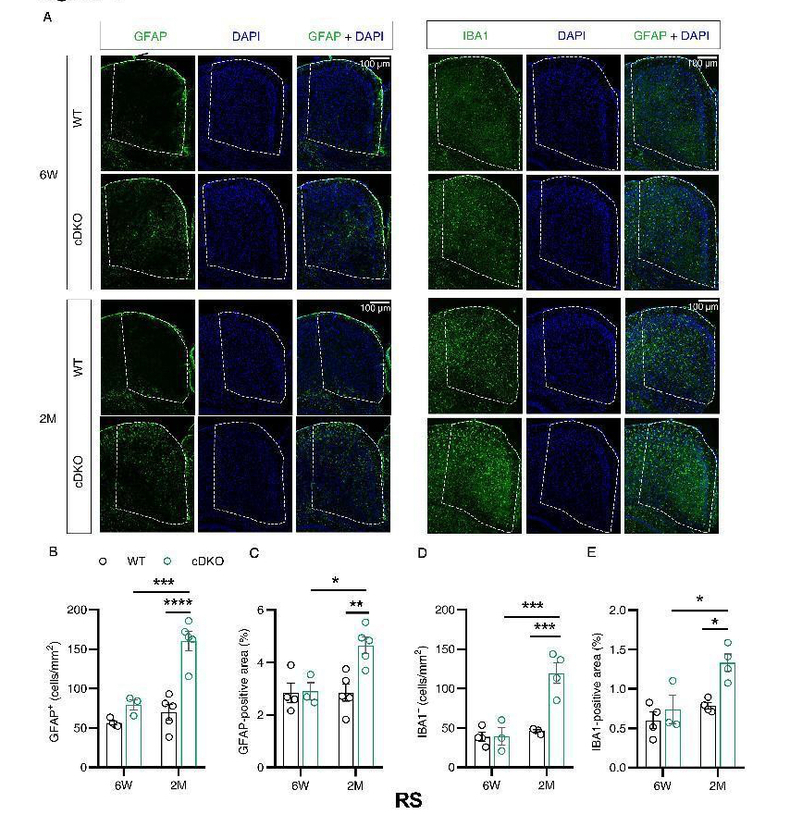
图2.二月龄早发性AD模型动物压后皮层(RS)星形胶质细胞和小胶质细胞的数量均增加
值得注意的是,研究还发现,随着年龄的不断增长,早发性AD模型动物不同脑区的胶质细胞数量的增加越来越明显,并随龄不断恶化(图略)。
为了确定哪些基因表达的变化可能与早发性AD模型动物皮层脑区的胶质细胞增生相关,该研究对两月龄动物进行了皮层的基因测序分析,发现在发病早期阶段大量上调表达的基因主要参与免疫炎症反应的调节过程,同时还发现了两个关键的蛋白质互作网络,分别是免疫应答和小胶质细胞活化相关的基因网络和细胞因子/趋化因子相关基因网络(图3)。
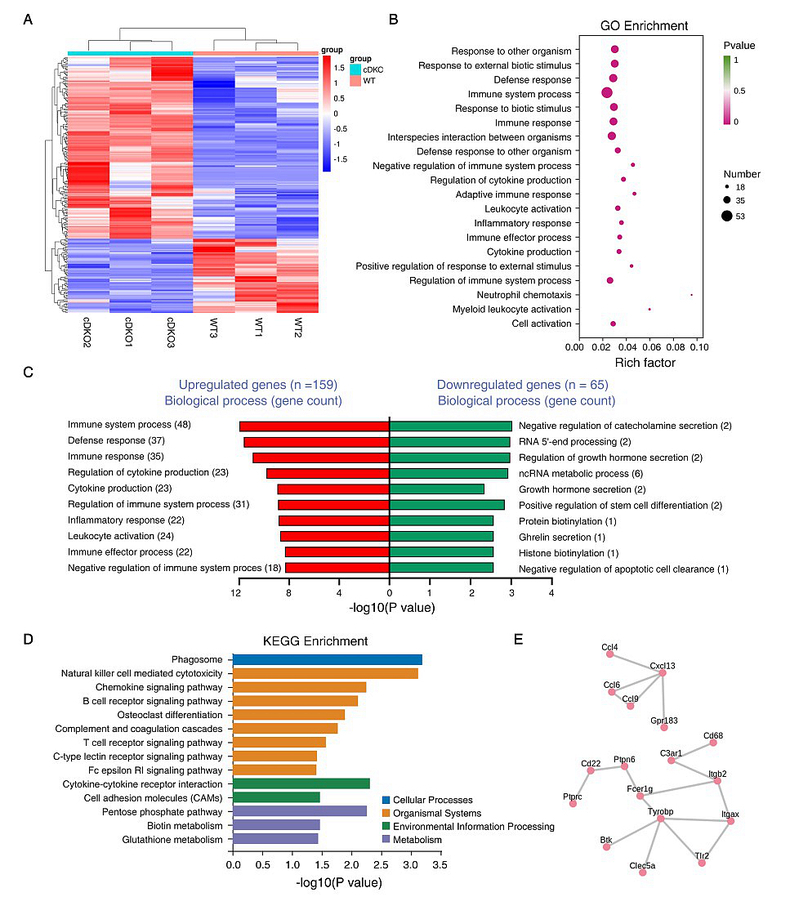
图3.基因测序分析发现关键的免疫炎症分子通路参与早期疾病发生
鉴于在早发性AD模型动物早期神经退行性病变过程中观察到胶质细胞增生,那么在早发性AD模型动物的不同脑区,胶质增生的增加是否伴随着相应的神经炎症因子随年龄的变化?研究发现,两月龄早发性AD模型动物皮层中的趋化因子Ccl4的基因表达水平显著升高 (图4),且出现的时间远早于其他Ccl基因,这提示Ccl4上调可能伴随或先于星形胶质细胞和小胶质细胞活化,并且很可能是预测神经退行性病变发生和进展的早期事件。
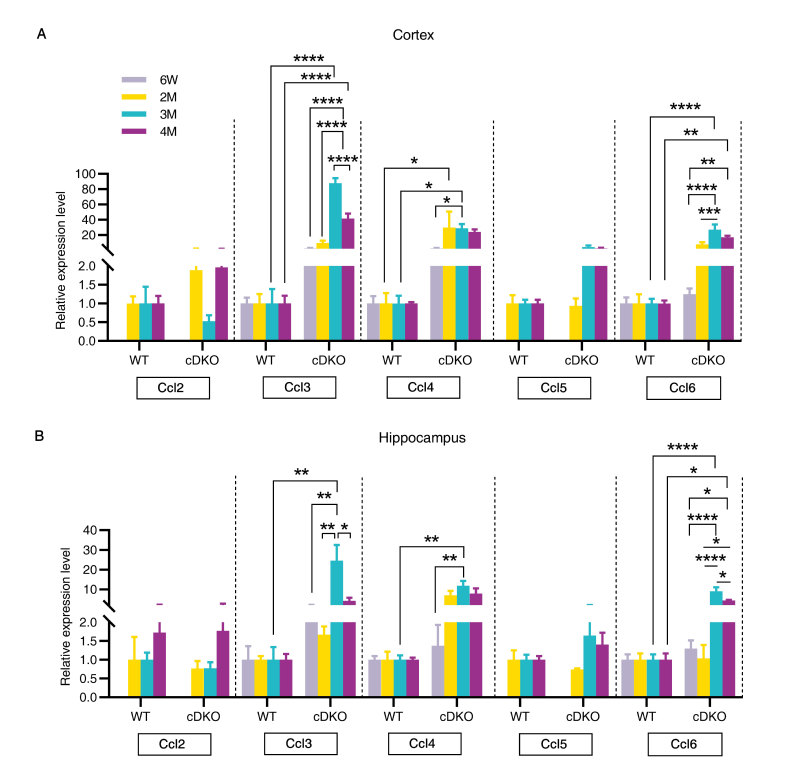
图4.早发性AD模型动物皮层和海马中趋化因子的表达随龄增加
此外,在四月龄早发性AD模型动物的皮层中也观察到一些补体基因和组织蛋白酶家族基因的表达显著增加,但在两月和三月龄时却未观察到其改变(图略),这表明补体系统失调及组织蛋白酶功能障碍可能是早发性AD模型动物神经退行性病变发生和进展的后期事件。
综上,星形胶质细胞和小胶质细胞的激活以及神经炎症因子(如趋化因子)的同时增加作为早期事件,可能是早发性AD的风险基因早老素缺乏引起的神经退行性病变的发病和进展的关键机制。以上结果提示:在神经退行病变的早期阶段,降低星形胶质细胞和小胶质细胞的活化水平及炎症相关的趋化因子表达,可能是预防神经退行性病变发生和发展的一个有吸引力的治疗策略。
华东师范大学心理与认知科学学院硕士毕业生彭文君为第一作者,硕士研究生谢园和廖翀正,博士研究生白云霞为共同作者,华东师范大学李春霞副研究员和王惠敏研究员为本论文的共同通讯作者。该研究得到了上海市自然科学基金(No. 16zr1410100, No. 20ZR1416600,李春霞)、“中央高校基本科研业务费专项资金”及“华东师范大学附属医院合作研究基金项目”的资助。
论文信息:
Peng, W., Xie, Y., Liao, C., Bai ,Y., Wang, H.*, Li, C. *(2022). Spatiotemporal patterns of gliosis and neuroinflammation in presenilin 1/2 conditional double knockout mice. Frontiers In Aging Neuroscience. online published. doi: 10.3389/fnagi.2022.966153/full.
图文|彭文君 李春霞